رمزگشایی از برهمکنشهای پروتئین-نانوذره با استفاده از بیوفیزیک
محققان دینامیک برهمکنش آلبومین سرم گاوی و نانوذرات سیلیس را با استفاده از روشهای طیفسنجی بررسی کردند.
نانوذرات (NPs) به دلیل ابعاد نانومقیاس و خواص قابل تنظیم مواد، در سالهای اخیر مورد توجه جامعه علمی جهانی قرار گرفتهاند. کاربردهای نانوذرات در حوزه سلامت انسان شامل سیستمهای دارورسانی مبتنی بر نانوذرات و نانوذرات متصل به پروب رادیواکتیو برای تشخیص پزشکی است. در حالی که پیشرفتهای قابل توجهی در طراحی و سنتز نانوذرات حاصل شده است، مطالعاتی که برهمکنشهای نانوذرات با ماکرومولکولهای مهم بیولوژیکی مانند پروتئینها را بررسی میکنند، همچنان محدود هستند.
برای آشکار کردن علم پشت برهمکنش پروتئین-نانوذره و پیامدهای آن برای سلامت انسان، تیمی از محققان به رهبری دانشیار ماساکازو اومزاوا از گروه طراحی مهندسی پزشکی و رباتیک، دانشکده مهندسی پیشرفته، دانشگاه علوم توکیو، ژاپن، مجموعهای از آزمایشهای مبتنی بر طیفسنجی را انجام دادند. این تیم تحقیقاتی متشکل از آقای نائویا ساکاگوچی، دانشجوی سال دوم دکترا از دانشکده علوم و فناوری مواد، دانشکده مهندسی پیشرفته، دانشگاه علوم توکیو، و دانشیار جوان آتسوتو اونودا از دانشگاه شهر سانیو-اونودا بود.
یافتههای تحقیقاتی آنها در مجله Langmuir تغییرات در ساختار ثانویه پروتئین روی سطح نانوذرات سیلیس با اندازههای مختلف منتشر شد.
در مطالعه خود، محققان از آلبومین سرم گاوی (BSA) به عنوان پروتئین اصلی مورد نظر و نانوذرات سیلیس (SiNPs) با قطرهای مختلف از 10 نانومتر تا 10 میکرومتر (10000 نانومتر) استفاده کردند. آنها برهمکنشهای پروتئین-نانوذره را با استفاده از فلورسانس تیوفلاوین T (ThT)، طیفسنجی مادون قرمز تبدیل فوریه (FT-IR) و دورنگنمایی دایرهای (CD) تجزیه و تحلیل کردند.
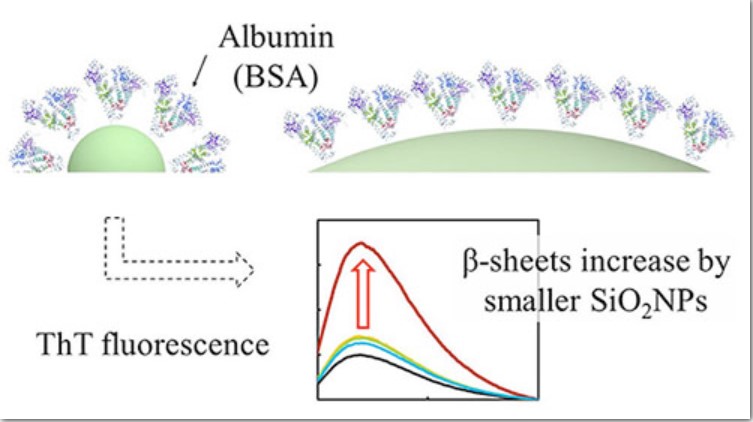
شکل 1- نتایج تجزیه و تحلیل فلورسانس تیوفلاوین T افزایش شدید شدت فلورسانس را هنگام مخلوط شدن BSA با نانوذرات سیلیکا (NPs) بسیار کوچک (10 نانومتر) با زمان هم زدن یک ساعت نشان داد. نانوذرات بسیار کوچک میتوانند تغییرات غیرطبیعی در ساختار پروتئین ایجاد کنند و پتانسیل ایجاد شرایط پاتولوژیک مانند بیماری آلزایمر را دارند. (تصویر: دکتر ماساکازو اومزاوا از دانشگاه علوم توکیو)
دکتر اومزاوا در توضیح انگیزهی این مطالعه میگوید: «هنگامی که نانوذرات به صورت درونتنی (in vivo )تجویز میشوند، ممکن است برهمکنشهایی با پروتئینها و سایر مولکولهای زیستی رخ دهد که منجر به تعدیل اثرات بیولوژیکی آنها میشود. بنابراین، اثبات ایمنی نانوذرات به همراه روشن شدن اثرات نانوذرات بر ساختار ثانویه پروتئینها بسیار مهم است.
دانشمندان دریافتند که شدت فلورسانس ThT با افزایش اندازه SiNP کاهش مییابد. نکته قابل توجه این است که وقتی BSA با SiNPهای 10 نانومتری در زمان هم زدن یک ساعت مخلوط شد، افزایش شدیدی در شدت فلورسانس ThT مشاهده شد. با این حال، وقتی BSA با بزرگترین SiNPها (10 میکرومتر) برای زمانهای هم زدن طولانیتر تا 48 ساعت مخلوط شد، شدت فلورسانس ThT به طور قابل توجهی بالاتر بود. دکتر اومزاوا میگوید: «افزایش تشکیل صفحات بتا در BSA، فراوانترین پروتئین موجود در سرم و مایع مغزی نخاعی، در طول برهمکنش با SiNPهای 10 نانومتری به طور قابل توجهی بالا است. این نشان میدهد که SiNPهای بسیار کوچک میتوانند باعث ایجاد ساختار غیرطبیعی پروتئین شوند و پتانسیل ایجاد شرایط پاتولوژیک مانند بیماری آلزایمر را دارند که شامل تشکیل پپتیدهای بتا آمیلوئیدی میشود.»
آزمایشهای FT-IR بیشتر برای مطالعه ساختار پروتئین ثانویه BSA نتایج متنوعی را نشان داد. میزان ساختارهای صفحات بتا در BSA با زمان هم زدن طولانیتر در حضور SiNPهای 10 میکرومتری افزایش یافت. برای به دست آوردن تصویر بهتری از دینامیک برهمکنش پروتئین-نانوذره، دکتر اومزاوا و تیمش توجه خود را به CD معطوف کردند. با استفاده از تکنیک انتخاب ساختار بتا (BeStSel) که میتواند به طور خاص پیکهای مشتق شده از صفحات بتا را تشخیص دهد، آنها دریافتند که ساختار مارپیچ آلفای BSA در اثر برهمکنش با SiNPها مختل میشود. در حالی که درصد ساختار α-مارپیچ در BSA در طول برهمکنش با SiNPها کاهش یافت، تأیید پروتئینهای صفحه بتای موازی به طور فزایندهای مورد توجه قرار گرفت.
به طور خلاصه، این مطالعه تأثیر نانوذرات بسیار کوچک بر ماکرومولکولهای بیولوژیکی، مانند پروتئینها را نشان میدهد. بینشهای حاصل از برهمکنش پروتئین-نانوذره میتواند توسعه سیستمهای ایمن و مؤثر مبتنی بر نانوذرات را برای کاربردها در زمینههای مختلف زیستشناسی پزشکی هدایت کند.
منبع:
https://www.tus.ac.jp/en/mediarelations/archive/20250623_7229.html









